生物(wù)相容性評價
一、醫(yī)療器械生物(wù)相容性評價的定義
根據ISO 10993-1:2018的定義,生物(wù)相容性是指醫(yī)療器械或材料在一個特定應用(yòng)中(zhōng)引起恰當宿主反應的能(néng)力。生物(wù)相容性是一個動态的概念。植入物(wù)植入人體(tǐ)後,對特定的生物(wù)組織環境會産(chǎn)生物(wù)理(lǐ)的和化學(xué)的影響進而引起生物(wù)學(xué)反應;反之,生物(wù)組織對植入物(wù)也會産(chǎn)生影響,使之發生物(wù)理(lǐ)的或化學(xué)的變化,兩者的相互作(zuò)用(yòng)一直持續。即使植入物(wù)被完全去除或被人體(tǐ)完全吸收,其影響還将持續一定時間。

二、醫(yī)療器械生物(wù)相容性評價的主要目标
除了少數一些器械獨有(yǒu)的評價方式,如細胞毒性、植入後局部反應、血液相容性、生物(wù)降解等,醫(yī)療器械生物(wù)相容性評價的方法大多(duō)數是由化學(xué)品或藥物(wù)的毒理(lǐ)學(xué)試驗方法發展而來。對于醫(yī)療器械,生物(wù)相容性評價的主要目的就在于評價這些小(xiǎo)分(fēn)子物(wù)質(zhì)造成的影響而并不僅是材料本身。還有(yǒu)一些器械,如以協助組織重塑和再生為(wèi)目的可(kě)吸收性植入性器械,對其生物(wù)相容性的評價不僅僅是針對上述小(xiǎo)分(fēn)子物(wù)質(zhì)或降解産(chǎn)物(wù),還包括其能(néng)否提供适合宿主細胞粘附、遷移、生長(cháng)、分(fēn)化的微環境,這是生物(wù)相容性概念的拓展。這裏的“生物(wù)相容”與器械的微結構、降解動力學(xué)、生物(wù)力學(xué)性能(néng)、表面理(lǐ)化性能(néng)以及微量化學(xué)物(wù)質(zhì)釋放等均息息相關。
三、生物(wù)相容性評價的開展方式
醫(yī)療器械風險管理(lǐ)是保證醫(yī)療器械安(ān)全有(yǒu)效的一項重要質(zhì)量管理(lǐ)活動,貫穿于從設計開發到臨床應用(yòng)的醫(yī)療器械全生命周期。生物(wù)相容性風險作(zuò)為(wèi)醫(yī)療器械風險管理(lǐ)的一個重要方面,也是貫穿其始終的。對于直接或間接接觸人體(tǐ)的醫(yī)療器械來說,良好的生物(wù)相容性是其臨床安(ān)全有(yǒu)效應用(yòng)的先決條件,是對其整體(tǐ)進行受益-風險評估的基礎。
(一)産(chǎn)品研發早期的生物(wù)相容性評價
在醫(yī)療器械的早期研發階段,生物(wù)相容性評價主要針對原材料、生産(chǎn)工(gōng)藝參數、加工(gōng)助劑的篩選。對于醫(yī)療器械原材料的選擇,主要考慮其是否滿足醫(yī)療器械的設計輸入。而原材料種類一旦選定,接下來的問題就是需要确認外購(gòu)的原材料級别或者自制原材料質(zhì)量是否适合用(yòng)于生産(chǎn)預期設計的醫(yī)療器械。目前對于醫(yī)用(yòng)級材料或植入級材料尚無确切的定義。有(yǒu)的材料供應商(shāng)對自己的材料有(yǒu)着相應級别的區(qū)分(fēn),以用(yòng)作(zuò)不同用(yòng)途。雖然最終的安(ān)全性責任是由醫(yī)療器械制造商(shāng)承擔的,但醫(yī)療器械制造商(shāng)在選擇材料時仍需考慮供應商(shāng)給出的建議。在篩選不同的材料或材料級别時,可(kě)以運用(yòng)生物(wù)相容性評價的方式。此階段的生物(wù)相容性需結合所能(néng)收集到的各種材料信息,如供應商(shāng)提供的材料安(ān)全數據單(MSDS)、主文(wén)檔(MAF)登記信息對于材料的篩選可(kě)能(néng)并不充分(fēn),還需通過化學(xué)表征對原材料的雜質(zhì)進行分(fēn)析,或者一些短期的、體(tǐ)外的生物(wù)學(xué)試驗來進行驗證。對于不同種類的加工(gōng)助劑,不僅需要考慮其功能(néng)性,還要考慮其是否引入毒性物(wù)質(zhì),以及是否容易在後續工(gōng)序中(zhōng)去除。而對于加工(gōng)助劑殘留量可(kě)接受性的确認,也會用(yòng)到生物(wù)相容性評價方法,一般是采用(yòng)對殘留助劑的化學(xué)表征和毒理(lǐ)學(xué)評價相結合的方式。
(二)終産(chǎn)品的生物(wù)相容性評價
對于已設計定型并在完善的質(zhì)量管理(lǐ)體(tǐ)系下生産(chǎn)的醫(yī)療器械終産(chǎn)品,若其預期與人體(tǐ)直接或間接接觸,則在其進行人體(tǐ)臨床應用(yòng)或臨床試驗之前,需對其進行充分(fēn)、完整的生物(wù)相容性評價。終産(chǎn)品的生物(wù)相容性評價需要首先了解産(chǎn)品相關的化學(xué)組成,如原材料、加工(gōng)助劑、工(gōng)藝中(zhōng)可(kě)能(néng)引入的污染物(wù)、可(kě)能(néng)生成的材料降解産(chǎn)物(wù)等,甚至需要考慮原材料本身制造過程引入的雜質(zhì)(可(kě)以從原材料供應商(shāng)處獲取相關信息),在此基礎上還可(kě)對終産(chǎn)品進行材料表征和可(kě)瀝濾物(wù)分(fēn)析以進一步驗證其組成成分(fēn)和雜質(zhì)水平。建立在對産(chǎn)品化學(xué)組成和雜質(zhì)水平充分(fēn)了解基礎上的生物(wù)相容性評價才更加可(kě)靠。
生物(wù)相容性評價路徑
生物(wù)相容性評價有(yǒu)兩種路徑:整體(tǐ)評價路徑和終點評價路徑(如圖1 所示)
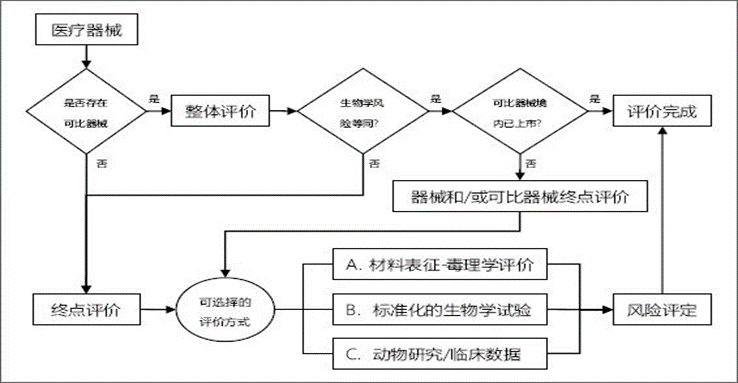
圖1 生物(wù)相容性評價路徑
(1)整體(tǐ)評價路徑
此種評價路徑不需要選擇評價終點,因為(wèi)是對器械進行整體(tǐ)生物(wù)學(xué)風險的評估,但前提是所評價的終産(chǎn)品存在可(kě)比器械。可(kě)比器械為(wèi)已在境内上市的器械或生物(wù)相容性評價證據鏈完整的器械,一般為(wèi)本企業器械才具(jù)有(yǒu)可(kě)比性。可(kě)比器械如果與待評價器械在任何可(kě)能(néng)與生物(wù)學(xué)風險相關的方面(如材料配方和來源、生産(chǎn)工(gōng)藝和滅菌工(gōng)藝、物(wù)理(lǐ)狀态、表面結構、初包裝(zhuāng)材料,以及與人體(tǐ)的接觸等)均相同,則可(kě)直接得出産(chǎn)品生物(wù)學(xué)風險等同的結論。若有(yǒu)任何細微差别,可(kě)針對差别進行相關的對比分(fēn)析并補充評價,以支持相關差異帶來的額外生物(wù)學(xué)風險可(kě)接受。例如,其中(zhōng)某一種原材料的來源不同,可(kě)根據其接觸途徑等,必要時開展适度的化學(xué)表征對其進行對比分(fēn)析,證明是否産(chǎn)生額外的生物(wù)學(xué)風險。若可(kě)比器械為(wèi)已在境内上市的醫(yī)療器械,則生物(wù)相容性評價完成;若可(kě)比器械未在境内上市,則需針對各個評價終點确認可(kě)比器械的生物(wù)相容性評價證據鏈是否完整,不完整的補充進行生物(wù)相容性評價。
(2)終點評價路徑
如果所評價的終産(chǎn)品不存在可(kě)比器械,則需要步入終點評價路徑,即針對各個評價終點進行評價。一般可(kě)參照GB18666. 1(ISO 10993-1)中(zhōng)的評價終點矩陣圖,根據終産(chǎn)品與人體(tǐ)接觸的途徑和時間确定需要評價的終點,如細胞毒性等。一些器械有(yǒu)對應的國(guó)家标準或行業标準,可(kě)參考相關标準進行選擇。終點确定後,不同的終點可(kě)以選擇不同的評價方式。一般有(yǒu)下列三種評價方式可(kě)供選擇:
A. 材料表征-毒理(lǐ)學(xué)評價
材料表征-毒理(lǐ)學(xué)評價即參照GB/T 16886. 18(ISO10993-18)進行材料化學(xué)表征,參照GB/T16886. 17(ISO 10993-17)進行毒理(lǐ)學(xué)評價。此種方式一般适用(yòng)于評價系統性的毒性終點,如全身擊性、遺傳毒性、生殖毒性、緻癌性。當生物(wù)學(xué)試驗的不确定度很(hěn)高時,可(kě)以考慮采用(yòng)材料表征-毒理(lǐ)學(xué)評價的方式作(zuò)為(wèi)補充,但這種方式一般不用(yòng)于評價細胞毒性、緻敏、植入後局部反應、血液相容性等終點。毒理(lǐ)學(xué)阈值(TTC)評價方法也屬于此種方式。
B. 标準化的生物(wù)學(xué)試驗
标準化的生物(wù)學(xué)試驗采用(yòng)終産(chǎn)品或有(yǒu)代表性的樣品作(zuò)為(wèi)試驗材料。無法直接試驗的,通常用(yòng)其浸提液進行試驗。浸提的原則是盡可(kě)能(néng)與臨床建立聯系,在标準的浸提條件中(zhōng)盡可(kě)能(néng)選擇更苛刻的條件,以獲得更大的安(ān)全系數,如在材料不發生變化的情況下選擇提取能(néng)力更強的浸提介質(zhì)、更高的浸提溫度、更高的浸提比例、更長(cháng)的浸提時間等,但有(yǒu)時兩種浸提條件之間相比并不存在絕對的嚴苛性。劑量選擇也是在可(kě)行性和盡可(kě)能(néng)大的安(ān)全系數之間的平衡。對于多(duō)次使用(yòng)的器械還需要考慮生物(wù)學(xué)反應的積累效應。需要确認生物(wù)學(xué)試驗的樣品能(néng)夠代表最差狀态,如貨架儲存時間的考慮。對于觀察局部反應的試驗如植入試驗、刺激試驗等,樣品制備時還需要考慮表面結構的影響。為(wèi)便于結果的分(fēn)析,生物(wù)學(xué)試驗還需考慮是否設置對照,如陰性對照、陽性對照等。需注意的是,對于藥械組合産(chǎn)品,生物(wù)學(xué)試驗結果可(kě)能(néng)會受到幹擾,需要考慮是否将終産(chǎn)品和不含藥部分(fēn)分(fēn)别進行評價。當然,試驗的質(zhì)量控制也是非常重要的方面。

C. 動物(wù)研究/臨床數據
一般所說的動物(wù)研究指的是模拟臨床使用(yòng)途徑的原位動物(wù)試驗,主要用(yòng)于醫(yī)療器械臨床前可(kě)行性、有(yǒu)效性、安(ān)全性研究的目的。雖然其并不能(néng)充分(fēn)識别生物(wù)學(xué)風險,但在一些特殊情形中(zhōng)也可(kě)以起到補充生物(wù)相容性評價的作(zuò)用(yòng)。例如,當血栓形成試驗中(zhōng)出現血栓評級較高的情況,可(kě)結合動物(wù)研究中(zhōng)的血栓形成數據對結果的可(kě)接受性進行綜合評價。還有(yǒu)對于帶有(yǒu)藥物(wù)塗層的球囊擴張導管評價藥物(wù)的亞慢性毒性時也可(kě)結合動物(wù)研究中(zhōng)的數據進行觀察。但是,如果用(yòng)動物(wù)研究方式代替部分(fēn)生物(wù)學(xué)試驗來評價醫(yī)療器械的生物(wù)相容性,則需考慮動物(wù)研究是否符合GB/T 16886(ISO 10993)系列标準對于相應生物(wù)學(xué)試驗的觀察指标、觀察時間點、動物(wù)數量、樣品數量等具(jù)體(tǐ)要求。
臨床數據雖然是最接近醫(yī)療器械真實應用(yòng)安(ān)全性、有(yǒu)效性的數據,但由于其觀測方式的局限性以及其他(tā)幹擾因素等條件所限,對于生物(wù)學(xué)風險的識别可(kě)能(néng)并不敏感,因此臨床數據一般不能(néng)直接用(yòng)于生物(wù)相容性評價,但可(kě)作(zuò)為(wèi)産(chǎn)品生物(wù)相容性評價的有(yǒu)益補充,例如,對于某些生物(wù)學(xué)試驗結果的臨床可(kě)接受性評估具(jù)有(yǒu)重要參考意義。
以上三種評價方式可(kě)以互相補充,對生物(wù)相容性評價提供完整證據鏈。如果評價數據為(wèi)文(wén)獻或曆史數據,需要考慮适用(yòng)性和數據質(zhì)量等問題。
以上兩條評價路徑也可(kě)結合起來,如部分(fēn)終點采用(yòng)可(kě)比器械數據,部分(fēn)終點采用(yòng)待評價器械數據。
(三)生物(wù)相容性評價結果的接受準則
生物(wù)相容性評價的結果并不能(néng)單獨依據生物(wù)學(xué)試驗的數據讨論是否可(kě)以接受。醫(yī)療器械的生物(wù)相容性是否可(kě)接受是基于對終産(chǎn)品的受益和風險進行綜合分(fēn)析進而判斷的,因此需結合醫(yī)療器械的各項非臨床和臨床研究數據以及其相關産(chǎn)品的臨床應用(yòng)信息。需要注意的是,并不是所有(yǒu)的生物(wù)學(xué)反應都是不良的,或是不期望的,有(yǒu)些反應是材料或其降解産(chǎn)物(wù),結合特定的物(wù)理(lǐ)作(zuò)用(yòng)(如生物(wù)力學(xué)作(zuò)用(yòng))來激發宿主做出的适當應答(dá)。
(四)持續進行的生物(wù)相容性評價
由于醫(yī)療器械的生物(wù)相容性評價貫穿于産(chǎn)品全生命周期,因此在産(chǎn)品上市後,仍然需持續關注其生物(wù)相容性。例如産(chǎn)品在運輸、儲存過程中(zhōng)的變化是否引起其生物(wù)相容性的改變。例如對于持久植入的器械,其遠(yuǎn)期的生物(wù)相容性信息如何在上市後評價中(zhōng)收集。例如原材料和加工(gōng)助劑的來源和技(jì )術條件、産(chǎn)品配方、生産(chǎn)工(gōng)藝、初包裝(zhuāng)、滅菌、适用(yòng)範圍等的變化是否引入新(xīn)的生物(wù)學(xué)風險,如果引入則需補充進行生物(wù)相容性評價。
